Imunização contra Papilomavirus Humano: uma revisão de literatura sobre a utilização de vacinas profiláticas recombinantes
Dionela Pequeno Peres[1]
Orientadora: Esp. Cristina Barbosa Soares Fernandes[2]
RESUMO
O HPV é a infecção viral mais comum do trato reprodutivo. Existem mais de 200 tipos de HPV, dos quais pelo menos 15 são cancerígenos. O HPV é transmitido sexualmente, onde a maioria dos casos é no início da vida sexual. O câncer do colo do útero é adquirido com certos tipos de HPV. Dois tipos de HPV (16 e 18) são responsáveis por 70% dos cânceres do colo do útero e lesões pré-cancerosas. A criação da vacina contra o HPV teve grande importância, pois atua na atenuação do vírus e suas lesões induzidas, tendo como consequência a diminuição dos índices de CCU. O presente trabalho consiste em uma revisão literária, com foco na imunização contra o HPV, sua adesão e eficácia. Ao longo dessa pesquisa percebeu-se que o Papilomavirus Humano é um vírus que infecta homens e mulheres do mundo todo, sendo altamente prevalente em indivíduos jovens e sexualmente ativos e a melhor forma de prevenção atualmente contra o câncer de colo de útero é a vacina. Sendo necessário o desenvolvimento de estratégias eficazes de educação em saúde.
Palavras-chave: Papilomavirus Humano. HPV. Vacina.
ABSTRACT
HPV is the most common viral infection of the reproductive tract, with over 200 types, at least 15 of which are carcinogenic. HPV is sexually transmitted, and most cases occur early in sexual life. Cervical cancer is linked to certain types of HPV, with types 16 and 18 responsible for 70% of cervical cancers and precancerous lesions. The development of the HPV vaccine has been highly significant, as it helps reduce the impact of the virus and the lesions it causes, ultimately lowering the rates of cervical cancer. This paper is a literature review focusing on HPV immunization, its adoption, and effectiveness. Throughout this research, it was observed that Human Papillomavirus (HPV) is a virus that affects both men and women worldwide, with a particularly high prevalence among young and sexually active individuals. The most effective form of prevention against cervical cancer currently is vaccination. Therefore, the development of effective health education strategies is essential.
Keywords: Human papilomavírus. HPV. vaccination.
Introdução
O câncer de colo de útero (CCU) é o terceiro tumor mais frequente na população feminina em todo o mundo, sendo a segunda causa de óbito por neoplasia entre as mulheres em idade reprodutiva. Seu modelo de carcinogênese é baseado em múltiplas etapas, iniciando-se com a infecção pelo Papilomavírus Humano (HPV), progressão para lesões pré-cancerosas, e posteriormente carcinoma, considerado um estágio crítico, tipicamente irreversível, onde células HPV positivas cruzam a membrana basal (Bouvard et al., 2021).
A criação da vacina contra o HPV teve grande importância, pois atua na propagação do vírus e suas lesões induzidas, tendo como consequência a diminuição dos índices de CCU. Atualmente existem três vacinas profiláticas contra o HPV aprovadas e registradas pela ANVISA e que estão comercialmente disponíveis. São elas, a bivalente, contra os sorotipos de HPV 16 e 18, a quadrivalente contra os sorotipos 6,11,16 e 18 e a nonavalente que imuniza contra os sorotipos 6,11,16,18, 31, 33, 45, 52 e 58 (Dias, Freitas, 2020).
Enquanto a vacina quadrivalente aumenta a proteção contra o HPV em 70% para câncer de colo do útero, a vacina nonavalente protege em cerca de 90%, porém, está disponível apenas na rede privada. Dessa forma, o tema escolhido para o presente trabalho é extremamente relevante, uma vez que se busca maior conhecimento a respeito das atitudes e práticas sobre a prevenção do câncer de colo uterino através da imunização.
Desta forma, objetivou-se avaliar através de uma revisão integrativa de literatura o uso da vacina profilática contra o HPV na prevenção de infecções pelo vírus e de lesões precursoras do câncer cervical em populações-alvo contribuindo assim para elaboração de políticas públicas.
Metodologia
O presente trabalho consiste em uma revisão literária de abordagem qualitativa, natureza básica, os objetivos serão exploratórios com foco na imunização contra o HPV, sua adesão, desafios e estratégias para efetivação do agente de imunização e sua relação com índices de CCU. Para a realização desta pesquisa foram utilizadas as principais bases de dados em ciências da saúde, como PubMed, BvMed, Scielo, Google Académico e Medline. Com o intuito de selecionar artigos relevantes e recentes nos últimos 10 anos, além de busca em sites que são referência na área oncológica como INCA e Ministério da Saúde.
Resultados e discussão
Estrutura e Proteínas Virais do HPV
O agente etiológico do papiloma humano, foi classificado pelo Comitê Internacional em Taxonomia de Vírus (ICTV) como pertencente à família Papillomaviridae divididos em 16 gêneros, e agrupados em espécies de acordo com suas propriedades biológicas distintas (Entiauspe et al., 2016).
Os HPVs são classificados em genótipos, baseados na homologia do DNA, sendo considerado um novo genótipo distinto aquele HPV que tiver seu genoma isolado e apresentar uma diversidade de 10% na sequência de nucleotídeos do gene L1 de todos os tipos de HPV anteriormente descritos. O papilomavírus apresenta tropismo específico por células epiteliais e mucosas, explorando as células de seu hospedeiro natural em seu favor, na indução de tumores (Entiauspe et al., 2016).
O genoma do HPV é dividido em 3 regiões: Early (E), Long Control Region (LCR) ou Upstream Regulatory Region (URR) eLate (L). A região Early, é assim denominada, porque expressa precocemente as suas proteínas no ciclo viral, sendo as proteínas E6 e E7 as mais importantes. O grau de expressão de E6 e E7 está relacionado ao grau de lesão cervical. Em lesões de baixo grau, o DNA do HPV é encontrado de forma epissomal, enquanto que em lesões de alto grau, o DNA HPV se une ao DNA da célula (Zardo et al., 2014).
A região E codifica oito proteínas virais: E1, E2, E3, E4, E5, E6, E7 e E8, também conhecidas como proteínas não-estruturais. As proteínas E1 e E2 são responsáveis pela replicação do DNA e controle da transcrição viral, juntas formam um complexo que aumenta a afinidade de E1 se ligar à origem da replicação (Diniz, 2019).
A oncoproteína E6, une-se à proteína supressora de tumor (p53) e acelera sua degradação, inativando sua ação no controle negativo do ciclo celular e na reparação do DNA. A proteína E7, interfere com a proteína do retinoblastoma (pRb), um produto do gene supressor de tumor, e às proteínas p107 e p130, semelhantes à Rb, das quais regulam negativamente a proliferação celular (Libonate, 2019).
A proteína viral tardia L1 é a principal proteína do capsídeo, correspondendo a 80% do conteúdo proteico viral, enquanto L2 é a menor proteína do capsídeo, e tem como função ligar-se ao DNA e facilitar o transporte da proteína L1 para o núcleo da célula (Libonate, 2019).
Como resultado da multiplicação em grande escala do vírus no interior da célula, são provocadas alterações citológicas. Em associação à infecção pelo vírus está a evidência de coilócito, caracterizado por uma célula escamosa (intermediária ou superficial), que exibe uma cavitação perinuclear bem demarcada com condensação periférica do citoplasma, e morfologia resulta da proteína E4 do vírus que atua rompendo o citoesqueleto da célula. A coilocitose pode ser observada em infecções por HPV de baixo e alto risco, sendo a sua presença analisada em amostras cervicais no exame de Papanicolaou, mesmo que em quantidade mínima, é indicativo de LSIL (Zimmer et al., 2020).
Figura 1 – LSIL: células escamosas eosinofilicas com cavidade perinuclear vazia, circundada por citoplasma condensado e um núcleo moderadamente aumentado de tamanho: coilócitos típicos (obj. 20x)
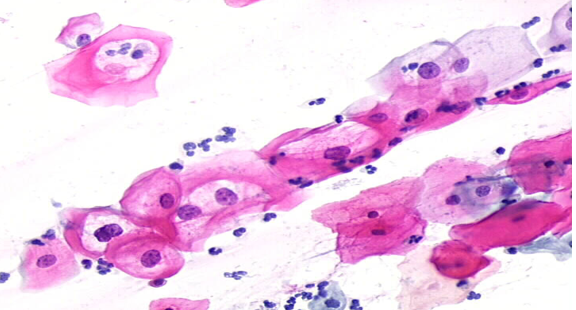
Fonte: International Agency for Research on Cancer IARC (2004)
Câncer de Colo de Útero e sua relação com HPV
A associação do vírus ao HPV com o câncer de colo de útero começou em 1949, posteriormente, o patologista George Papanicolaou introduziu o exame mais disseminado no mundo para detectar a doença, o Papanicolaou (Libonate,2019).
Esse exame, permitiu diagnosticar mulheres com alterações celulares pré-malignas, possibilitando observar a associação da atividade sexual com o desenvolvimento do câncer de colo de útero. Estudos averiguaram que tal associação implicava na presença de um agente etiológico de transmissão sexual. O infectologista alemão Harold Zur Housen, constatou que o HPV poderia ser esse agente, estabelecendo a relação do vírus com as verrugas e condilomas, somente alguns anos mais tarde, o vírus foi relacionado com o desenvolvimento do câncer de colo de útero (INCA,2019).
Na década de 90, o avanço da tecnologia possibilitou identificar o DNA do vírus HPV em amostras de tecido de carcinoma cervicais. Estudos confirmam a presença do DNA do HPV em quase 100% dos epitélios dos carcinomas invasivos. Casos de carcinoma sem presença do vírus HPV, são raros, e nestes casos, sugere-se que o carcinoma não foi originado pela infecção ou possa ter ocorrido falha na detecção do vírus (INCA,2019).
Os subtipos de HPV, classificam-se de acordo com seu potencial oncogênico, os tipos 6,11,42,43, e 44 são de baixo risco quando associados a lesões benignas, porém os tipos 16,18,31,33,35,39,45,51,52,56,58,59,66,68 e 70 são de alto risco em associação ao câncer cervical. O HPV, tem relação com quase 100% dos casos de câncer de Colo de útero; 85% de Ânus; 35% de Orofaringe e 23% de Boca (Esper, 2020).
A transmissão do vírus se dá por contato com pele ou mucosa infectada ou no parto. A principal forma de transmissão é por via sexual que inclui contato oral-genital, genital-genital ou mesmo manual-genital (Inca, 2023).
O vírus pode ficar inativo no corpo por muito tempo, sem apresentar manifestações clínicas, os infectados apresentam-se assintomáticos e são identificados após um rastreamento, o vírus também pode ser ativado em casos de baixa imunidade, estresse e gravidez, a maioria dessas infecções evoluem com caráter comum e benigno e de fácil tratamento. As mulheres, devem reconhecer os sintomas e buscar orientação médica se notarem sangramento incomum entre os períodos, após a menopausa ou após a relação sexual, corrimento vaginal aumentado ou com odor fétido, sintomas como dor persistente nas costas, pernas ou pélvis, perda de peso, fadiga e perda de apetite, desconforto vaginal, inchaço nas pernas. Avaliações e testes clínicos para confirmar o diagnóstico são importantes e serviços de tratamento, que podem incluir cirurgia, radioterapia e quimioterapia, bem como cuidados paliativos para fornecer cuidados de suporte e controle da dor (OMS, 2024).
Vacinas Profiláticas para infecção por HPV
A vacina age estimulando a imunidade ativa, que é desencadeada no sistema imune de uma pessoa, ao ter contato com algum tipo de bactéria ou vírus, que levará o organismo a produzir anticorpos ativando o sistema imunológico. Ao realizar a vacinação, a pessoa tem a oportunidade de seu organismo combater a doença (Godoi, 2019).
Ainda segundo Godoi (2019), as vacinas podem ser classificadas em:
Vivo Atenuada – A virulência (patogenicidade), ao passar pelo processo de atenuação o agente infeccioso é reduzida, e não irá causar a doença, mas sim, estimular a resposta imunológica.
Inativas ou Inerentes – Nas inteiras o patógeno é inativado com uma substância que irá incapacitar o agente infeccioso de se multiplicar, porém, a capacidade de estimular o sistema imune e preservada. As subunidades ou frações do agente infeccioso, são os agentes infecciosos empregados através de partículas fracionadas com toxinas anuladas ou porções. O benefício encontrado nesta vacina, é o fato delas serem seguras, por não ter a possibilidade de causar doenças, contudo são necessárias doses e reforços para estimular de forma adequada o sistema imune.
Recombinantes – são vacinas elaboradas mediante engenharia genética e técnicas de biologia molecular, onde é realizada a recombinação genética.
Visando combater a disseminação do vírus e o controlar as lesões por HPV induzidas, cientistas se voltaram num primeiro momento para o desenvolvimento de técnicas, capazes de detectar o HPV e após a identificação dos tipos mais prevalentes, desenvolver instrumentos para a prevenção primária do câncer de colo de útero. Esta realidade se fez presente com a indústria farmacêutica, anunciando a conclusão da fase de teste clínicos de vacinas profiláticas para a infecção do HPV (Derchain,2007).
No início do desenvolvimento das vacinas não havia técnicas laboratoriais que permitissem obter partículas virais em cultura de tecidos e inexistiam modelos animais para a infecção. Enquanto, a maioria das vacinas contra vírus é baseada no uso de virions para induzir a produção de anticorpos, não se conseguia produzir virions do HPV. A solução foi quando se descobriu que uma proteína, chamada então de L1, em combinação com a L2, gerava uma estrutura semelhante a encontrada nos virions. Esta estrutura, morfologicamente relacionada aos vírus, porém vazia, foi denominada de Virus-Like Particles (VLP). VLPs são destituídas de DNA e assim são consideradas seguras, pois são capazes de induzir forte resposta imune sem o risco de infecção ou de produzir uma neoplasia. Outra grande vantagem das VLPs é que podem ser produzidas utilizando células de insetos, bactérias ou até mesmo fungos (Libonate, 2019).
No Brasil, o primeiro registro da vacina para combater o HPV realizado pela Agência Nacional de Vigilância Sanitária (ANVISA) foi da Gardasil – quadrivalente ou tetravalente recombinante, contra os tipos 6,11,16,18 em julho de 2006 (Costa, et al, 2022).
Em 25 de fevereiro de 2008 foi registrada na ANVISA a vacina Cervarix – recombinante, bivalente, contra os tipos HPV 16 e 18 (Costa et al., 2022).
De acordo com o INCA, indivíduos do sexo masculino quando vacinados contra o HPV, reduzem em até 10% a frequência de consultas em clínicas relacionadas a infecções sexualmente transmissíveis. Uma vez que, quando portadores de lesões penianas contaminam mulheres através de ato sexual, sendo os homens, os principais responsáveis pela transmissão do vírus HPV para mulheres com vida sexual ativa (Santos, 2018).
Com o objetivo de aumentar a proteção das mulheres, reduzir a incidência de câncer de colo de útero e vulva, prevenir cânceres de pênis, boca, orofaringe e ânus em ambos os sexos, foi introduzido no ano de 2017, a vacina quadrivalente para indivíduos do sexo masculino no Brasil, sendo o país pioneiro da América Latina ao adotar essa medida no PNI, com metas estabelecidas de vacinação de no mínimo 80% dos meninos (Santos, 2018).
Em março de 2023, foi aprovado no Brasil o uso da vacina nonavalente indicada para homens e mulheres de 9 a 45 anos, a qual protege contra os quatro genótipos já contidos em Gardasil (6, 11, 16 e 18) e contra cinco adicionais (31, 33, 45, 52, 58), porém, está disponível apenas na rede privada de saúde do Brasil. Estudos indicam que esses cinco novos subtipos são responsáveis por um acréscimo de 20% dos casos de câncer de colo de útero (além dos 70% causados pelos quatro subtipos contidos na vacina quadrivalente), sendo os nove subtipos da vacina responsáveis por 85% dos casos de câncer vaginal. A nova vacina é superior ao que hoje encontra-se no Programa Nacional de Imunizações (PNI) devido a sua ampla abrangência viral, onde aumenta a sua proteção em 90%. Além disso, ela reduz a incidência de recidivas (quando o vírus retorna) (OMS,2024).
Segundo o cronograma de vacinação da rede pública de saúde, as vacinas disponíveis, podem ser aplicadas em pessoas a partir de 9 anos a 26 anos de idade. A recomendação da OMS, é que os países garantam que todas as meninas de 9 a 14 anos recebam pelo menos uma dose da vacina contra o HPV, a vacina tem mais eficácia antes que elas se tornem sexualmente ativas e entrem em contato com o vírus, ainda assim, meninas que já sejam sexualmente ativas, devem receber a vacina se estiverem dentro da faixa etária recomendada, pois, uma pessoa infectada por um subtipo ainda pode se proteger contra os outros ao se vacinar. A alta cobertura em meninas (>80%) reduz significativamente o risco de infecção em meninos (OPAS, OMS, 2024).
Índices, desafios e estratégias
A vacinação contra o HPV atualmente faz parte do programa nacional de imunização em 62 países, incluindo países de baixa e média renda, uma estratégia mundial para eliminar o câncer de colo de útero como problema de saúde pública, com o objetivo de diminuir para 4 casos por 100 mil mulheres até 2030 (Beyene; Tsige, 2024).
A África tem as maiores taxas regionais de incidência e mortalidade, com 7 a 10 vezes as taxas do mundo ocidental, em 2016, os programas de imunização contra o hpv atingiram apenas 12% das jovens adolescentes. Altos níveis de pobreza, questões culturais, justiça social, género, raça, etnia e geografia desempenham todos um papel nos efeitos do câncer de colo nas comunidades. Em comparação com as mulheres em países de rendimento elevado, as mulheres pobres com doenças avançadas têm taxas de mortalidade consideravelmente mais elevadas porque têm menos acesso ao diagnóstico e tratamento, o câncer de colo é um problema sério em países em desenvolvimento devido à baixa conscientização do público, dos profissionais médicos e dos formuladores de políticas (Beyene; Tsige,2024).
A taxa de cobertura vacinal, tem sido reportada como abaixo do recomendado em diversos países, como Uruguai, Itália, Canadá, sendo próxima a 40%. Entre os principais fatores está a falta de conhecimento e informação das adolescentes e de seus cuidadores sobre a eficácia e efeitos colaterais da vacina anti HPV. O Maior nível de recusa foi associado a condições socio econômicas desfavoráveis, como baixa renda familiar e baixo nível de escolaridade (Almeida et al., 2020).
Em 2019, países como Austrália, Inglaterra, México e Peru se destacaram em suas campanhas de vacinação, com um índice de até 97% de cobertura vacinal.
Como estratégia, usaram diferentes peças de comunicação médica e informativa direcionados a população em geral, as peças foram veiculadas na tv, radio, mídia digital e material impresso, eventos como workshops e campanhas com informações sobre a vacinação foram realizados (Santos, 2023).
Em 2014, ano da implantação da vacina o Brasil obteve um excelente resultado a cobertura vacinal de 101,4% em meninas de 9 a 13 anos, entretanto na segunda dose a cobertura vacinal foi de 59,8%. Segundo o Programa Nacional de Imunizações em 2015, a situação se repetiu com baixa nas duas doses 70,49% e 44,63% na primeira e segunda dose respectivamente em meninas de 9 a 11 anos (Dias, 2020).
Em 2019 identificou-se que a cobertura vacinal foi de 49,6%, abaixo da meta recomendada pela OMS, entre as principais causas da baixa adesão à campanha de vacinação estão, desconhecimento sobre o HPV e sobre a vacina, hesitação do público, baixo engajamento dos profissionais de saúde, dificuldade de acesso, alcance da promoção e políticas públicas deficientes (Santos, 2023).
Além desses fatores, a fake News também se tornou uma complicação, em 2019, o Ministério da Saúde reconheceu a dificuldade para aumentar a cobertura vacinal do HPV em meninas como consequência dessas notícias falsas (Sardinha,2023).
No Brasil, a disseminação sobre os efeitos adversos da vacinação contra o HPV se iniciou em Rio Branco através do relato de 72 casos de efeitos colaterais após a aplicação da vacina. Todavia, em um estudo realizado por Marchetti et al., (2020) concluiu que [...] “não houve qualquer associação biológica entre a vacina contra o HPV e os problemas clínicos apresentados pelos pacientes. Contudo, o impacto das fake News em Rio Branco poderia ter atingido todo o país e mesmo após a publicação do estudo, não houve aumento nas imunizações” (Marchetti et al., 2020, p. 11).
A Organização Pan-Americana de Saúde (OPAS, 2020) chamou de infodemia o excesso de informações precisas ou não que dificultam encontrar fontes idôneas e orientações confiáveis sobre um assunto específico, identificou que as fakes News sobre vacinas propagam as seguintes ideias: [...] “desconfiança, ineficácia, toxicidade, letalidade, provoca autismo, diminui autodefesa, causa microcefalia, tem como objetivo gerar lucro para quem produz as vacinas” (Ferreira, 2021, p. 07).
Com isso, é evidente que a disseminação dessas informações na vacinação contra o HPV gera consequências graves para a saúde feminina, devido ao quadro de vulnerabilidade imunológica gerada pela baixa adesão vacinal. Como exemplo de impacto relacionado a recusa vacinal, o aumento na incidência de câncer de colo do útero está entre os mais importantes (Sardinha, 2023).
Os resultados obtidos não são satisfatórios, apesar do compromisso do Brasil de atingir a meta de 90% de cobertura vacinal em meninas antes dos 15 anos. Portanto, é necessário tomar disposições urgentes para que o Brasil alcance a meta de vacinação até 2030 (Lopes, 2023).
Considerações finais
O câncer cervical é uma enfermidade que traz grandes preocupações em políticas de saúde, pela frequência elevada e pela gravidade. Globalmente é o terceiro câncer mais comum em mulheres e o segundo mais comum entre jovens de 15 e 44 anos de idade.
Estima -se que em 2020, houve 604 mil novos casos e 342 mil mortes no mundo todo, com expectativa de aumento nos próximos anos se não forem adotadas novas medidas de enfrentamento ao problema. Os números classificam essa neoplasia como grave questão de saúde pública.
Esta revisão literária, demonstra que apesar da vacina contra o HPV ser de extrema importância para reduzir os casos de câncer de colo de útero, a cobertura vacinal está abaixo dos níveis propostos e os principais motivos da recusa vacinal estão associados a falta de informação precisa sobre a vacina.
O problema da adesão à vacina deve ser analisado em diversos níveis de complexidade que variam ao longo do tempo, em diferentes locais, de acordo com os tipos de vacinas. Como solução para esse desafio, é essencial acompanhar a confiança nas vacinas e as razões para a recusa vacinal.
Desenvolver estratégias de educação em saúde, assegurando o fornecimento de informações sobre os perigos de enfermidades, ações de prevenção, dados confiáveis sobre o benefício da imunização esclarecendo duvidas e medos, a fim de aumentar a cobertura vacinal, faz-se necessário ações como: divulgação em tv, rádios, cartazes, ações de educação direcionadas aos adolescentes e seus responsáveis e ainda integração dos profissionais de saúde e educação nas campanhas de vacinação.
Referências
ALMEIDA, Rafaela Cristina Alves Altino; CASTRO, Jonathan Mendes de; OLIVEIRA, Talles Vinícius de Castro; OLIVEIRA, Thales Francisco de; ARAðJO, Diego Azevedo; ALENCAR, Nara Pereira de Faria Carvalho de; AZEVEDO, Marcela Alves; ARRUDA, Jacqueline Souza Dutra; GUERRA, Carlos Henrique Wernersbach; COSTA, Wendel Jose Teixeira. Cobertura vacinal ANTI-HPV e motivos de não vacinação. Revista Eletrônica Acervo Enfermagem, [S.L.], v. 2, n. 2, p. 1-9, fev.
BOUVARD, Véronique et al. The IARC perspective on cervical cancer screening. New England Journal of medicine, v. 385, n. 20, p. 1908-1918, 2021.
CARVALHO, Maria Cristina de Melo Pessanha; QUEIROZ, Ana Beatriz Azevedo. Lesões precursoras do câncer cervicouterino: evolução histórica e subsídios para consulta de enfermagem ginecológica. Escola Anna Nery, [S.L.], v. 14, n. 3, p. 617-624, set. 2010. FapUNIFESP (SciELO). http://dx.doi.org/10.1590/s1414-81452010000300026.
COSTA, Bianca Stephany Ramos; GUIMARÃES, Carolina; MORAIS, Caroline Rodrigues de; CAIXETA, Clara Ramos; CUNHA, Eduardo Prudencio da; CAETANO, Gabriela Martins Guimarães; PESSOA, Gabriela Rodrigues; MACHADO, Nathalia Oliveira Queiroz. UMA REVISÃO BIBLIOGRAFICA ACERCADA VACINA CONTRA O HPV E SEUS DESAFIOS. Brazilian Journal Of Health Review. Curitiba, p. 6392-6402. abr. 2022.
DIAS, Marcio Adriano P.; FREITAS, Bethania Alves de Avelar. VACINAÇÃO CONTRA O PAPILOMAVIRUS (HPV) NO BRASIL: histprico e desafios. Brazilian Journal Of Development. Curitiba, p. 74787-74797. out. 2020.
GODOI, Gabriela Ramos de; SILVA, Priscila Soares. A IMPORTANCIA DA CONSCIENTIZAÇÃO DA FAMILIA PARA O MELHOR ALCANCE DA VACINA CONTRA O HPV. 2019. 35 f. TCC (Graduação) - Curso de Enfermagem, Centro Universitario Unievangelica, Anapolis, 2019. Cap. 3.1
INCA. INSTITUTO NACIONAL DO CANCER. Disponível em:
https://www.gov.br/inca/pt-br. Acesso em: 15 jun. 2024.
LEVI, Monica. Atualizaçao das Vacinas HPV em uso no Brasil: introdução da nonavalente (hpv9). Introdução da Nonavalente (HPV9). 2023. Disponível em: WWW.SBIM.ORG.BR. Acesso em: 01 jun. 2024.
LIBONATE, Renata dos Santos Oliveira. A IMPLEMENTAÇÃO DA VACINA DO HPV COMO AGENTE DE IMUNIZAÇÃO. 2019. 28 f. Monografia (Especialização) - Curso de Citopatologia, Instituto Nacional do Cancer Jose de Lencar da Silva, Rio de Janeiro, 2019. Cap. 2.
LOPES, Raquel Justakowski; SIMÃO, Rita de Cássia Garcia; TURKIEWICZ, Maurício; PLEWKA, Jacqueline. Análise da vacinação contra o HPV no Brasil frente as metas implementadas até 2030 pela Organização Mundial da Saúde. Research, Society and Development, [S.L.], v. 12, n. 4, p. 1-9, 12 abr. 2023. Research, Society and Development. http://dx.doi.org/10.33448/rsd-v12i4.40845.
OPAS, Organização Pan-Americana de Saude -. VACINAÇÃO CONTRA O PAPILOMAVIRUS (HPV) NO BRASIL. Disponível em:
https://www.paho.org/pt/vacinacontravirusdopapilomahumanohpv#:~:text=Portanto%2C%20a%20vacina%20contra%20HPV,de%20longo%20prazo%20contra%20HPV... Acesso em: 02 out. 2024.
SANTOS, José Gilmar Costa; DIAS, Julia Maria Gonçalves. Vaccination public against human papillomavirus in Brazil. Revista Médica de Minas Gerais, [S.L.], v. 28, n. 1, p. 1-7, 18 jun. 2018. GN1 Sistemas e Publicacoes Ltd... http://dx.doi.org/10.5935/2238-3182.20180004.
TSIGE, Abate Wondesen; BEYENE, Dessale Abate. Cervical cancer: challenges and prevention strategies. Health Science Reports, [S.L.], v. 7, n. 6, p. 1-10, 30 maio 2024. Wiley. http://dx.doi.org/10.1002/hsr2.2149
ZARDO, Geisa Picksius; FARAH, Flávia Peixoto; MENDES, Fernanda Gabriela; FRANCO, Camila Ament Giuliani dos Santos; MOLINA, Giseli Vieira Machado; MELO, Gislaine Nochetti de; KUSMA, Solena Ziemer. Vacina como agente de imunização contra o HPV. Ciência & Saúde Coletiva, [S.L.], v. 19, n. 9, p. 3799-3808, set. 2014. FapUNIFESP (SciELO). http://dx.doi.org/10.1590/1413-81232014199.01532013.
[1] Graduanda: Dionela Pequeno Peres
[2] Professora: Cristina Barbosa Sores Fernandes